
大昌华嘉科学仪器部
 白金会员
白金会员 已认证
已认证

大昌华嘉科学仪器部
 白金会员
白金会员 已认证
已认证
Understanding the effects of additives on therapeutic protein stability is of paramount importance for obtaining stable formulations. In this work, we apply several high- and medium-throughput methods to study the physical stability of a model monoclonal antibody at pH 5.0 and 6.5 in the presence of sucrose, arginine hydrochloride, and arginine glutamate. In low ionic strength buffer, the addition of salts reduces the antibody colloidal and thermal stability, attributed to screening of electrostatic interactions. The presence of glutamate ion in the arginine salt partially reduces the damaging effect of ionic strength increase. The addition of 280 mM sucrose shifts the thermal protein unfolding to a higher temperature. Arginine salts in the used concentration reduce the relative monomer yield after refolding from urea, whereas sucrose has a favorable effect on antibody refolding. In addition, we show 12-month long-term stability data and observe correlations between thermal protein stability, relative monomer yield after refolding, and monomer loss during storage. The monomer loss during storage is related to protein aggregation and formation of subvisible particles in some of the formulations. This study shows that the effect of commonly used additives on the long-term antibody physical stability can be predicted using orthogonal biophysical measurements.
了解添加剂对治疗蛋白稳定性的影响对于获得稳定的配方至关重要。在这项工作中,作者应用了几种高通量和中通量的方法来研究模型单克隆抗体在pH 5.0和6.5的条件下,蔗糖,盐酸精氨酸和精氨酸谷氨酸存在的物理稳定性。在低离子强度缓冲液中,盐的加入降低了抗体的胶态和热稳定性,归因于静电相互作用的增加。精氨酸盐中谷氨酸离子的存在部分降低了离子强度增加的损伤作用。添加280mM蔗糖后,热蛋白的展开温度升高。使用浓度的精氨酸盐降低了尿素重折叠后的相对单体产率,而蔗糖对抗体重折叠有较好的作用。此外,作者还展示了12个月的长期稳定性数据,并观察了热蛋白稳定性、再折叠后的相对单体收率和单体在贮藏过程中的损失之间的相关性。贮存过程中单体的损失与某些配方中的蛋白质聚集和亚可见颗粒的形成有关。本研究表明,常用添加剂对抗体长期物理稳定性的影响可以通过正交生物物理测量来预测。
本研究中使用的单克隆抗体PPI13是一种人源IgG1k,分子量为148.9 kDa,等电点约为9。在不久的将来,关于PPI13的初级蛋白序列和其他信息将在一个在线数据库(https://pippi-data.kemi.dtu.dk/)中提供。PPI13以无表面活性剂的散装溶液提供,蛋白质浓度为43 g/L。采用尺寸排阻色谱(SEC)批量检测PPI13的纯度,显示相对单体含量>97%。如前所述,在25C条件下,用广泛透析交换缓冲液至10 mM组氨酸/组氨酸盐酸盐,pH分别为5.0、5.75和6.5采用Nanodrop 2000紫外分光光度计(Thermo Fisher Scientific, Wilmington, DE)测量PPI13在280 nm处的吸收,并用蛋白消光系数计算蛋白浓度。在组氨酸缓冲液中分别制备蔗糖、ArgHCl、ArgGlu、胍盐酸盐(GuHCl)和nacld4添加剂的原液,并将其添加到透析蛋白溶液中。所有化学品都是高纯度等级的,并从Sigma Aldrich (Steinheim,德国)、VWR International (Darmstadt,德国)或Fisher Scientific (Schwerte,德国)购买。来自arium®系统(Sartorius Lab Instruments GmbH, Goettingen, Germany)的超纯水用于制备所有溶液。
长期稳定实验
分别用缓冲液(或缓冲液加添加剂)中蛋白浓度为5 g/L的PPI13样品经过0.22 mmol醋酸纤维素过滤器的无菌过滤,无菌填充到DIN2R I型玻璃瓶(MGlas AG, Münnerstadt,德国),用氟rotec®涂层橡胶氯丁基塞压接(West Pharmaceutical Services)。并储存在4C和25C所需的时间。三个不同的小瓶被用来分析每个条件和时间

热蛋白的PPI13在不同pH值(a)和添加剂对热演变的影响在酸碱5.0 (d)和6.5 (g)的影响。温度对表面的水力半径Rh PPI13在不同pH值(b)和添加剂对Rh在加热的影响酸碱5.0 (e)和6.5 (h),温度对多余的散射效果不同pH (c)下的PPI13配方和添加剂对pH 5.0 (f)和pH 6.5 (i)加热过程中过量散射的影响。在a、c、d、f、g和i中,数据点密度降低以提高清晰度。所有样品中PPI13的浓度均为5 g/L。
PPI13在pH为5.0和6.5的10 mM组氨酸缓冲液中的稳定性指示参数。数值为三次重复的平均值,误差为标准差。

PPI13在pH 5.0 (a)和pH 6.5 (b)无添加剂(方形)、280 mM蔗糖(圆形)、140 mM ArgHCl(三角形上)和70 mM ArgGlu(三角形下)的情况下相互扩散系数的浓度依赖性。数据是由三份副本叠加而成的。这些线与点呈线性拟合。
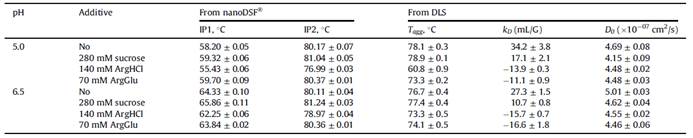
概述用SAXS获得的结果:PPI13在pH 5.0 (a)和pH 6.5 (b)时的P(r)函数,pH 5.0 (c)和pH 6.5 (d)时的Dmax, pH 5.0 (e)和pH 6.5 (f)时的Mm。
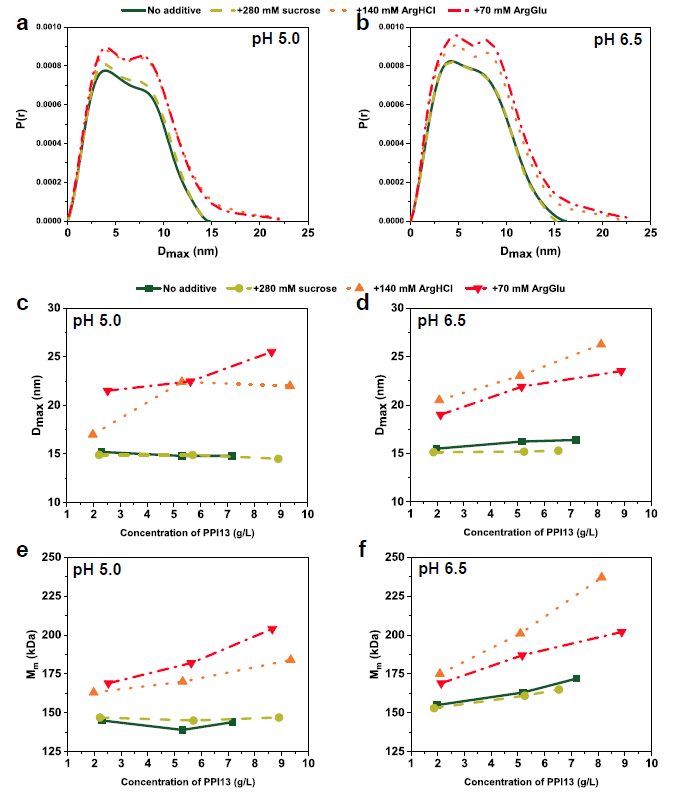
蛋白质添加剂饱和转移放大因素(AFSTD)测量单个原子的各种添加剂添加到PPI13 pH值5.0(左列)和6.5(右列),蔗糖(a和b), ArgHCl (c和d)和ArgGlu (e和f)。图下面的标签指定的单个原子AFSTD测量,插图显示了添加分子的化学结构,用于原子的匹配标记。
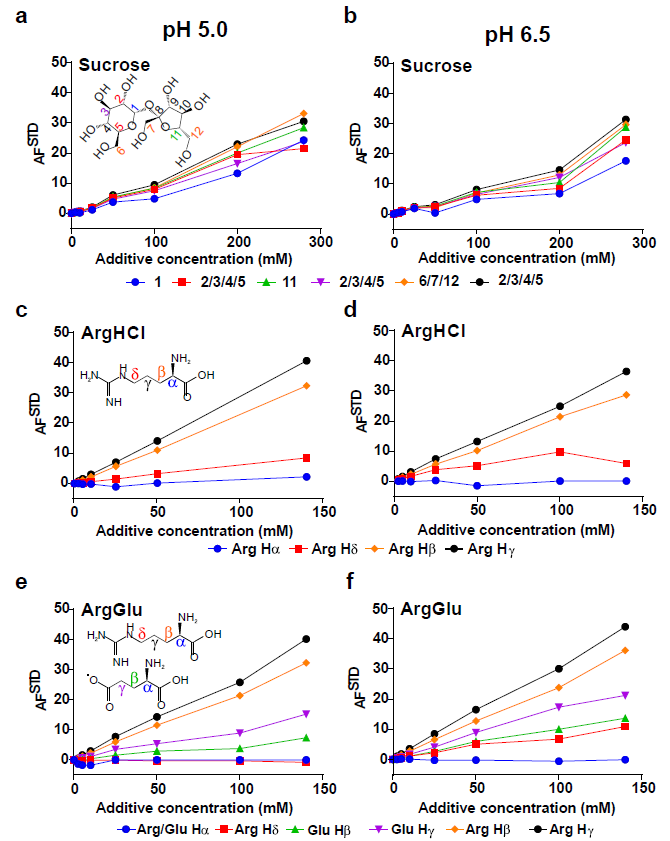
(a) 天然和折叠PPI13在10 mM组氨酸pH 5.0下的SEC色谱图。在一个单独的实验中,14.2分钟的峰值被确定为二聚体,使用SEC耦合到多角度光散射(数据未显示)。在pH 5.0 (b)和pH 6.5 (c)条件下,在不添加280 mM蔗糖、140 mM ArgHCl或70 mM ArgGlu的条件下,用9 M尿素重新折叠PPI13蛋白时,PPI13的相对单体产量和可溶性蛋白产量。b和c中的值为三次重复的平均值,误差棒为标准差。
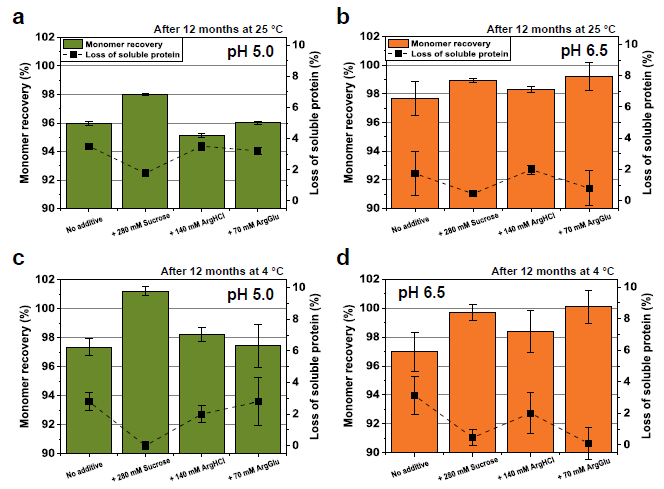
添加剂对贮存12个月后可溶PPI13的单体回收和损失的影响。(a) pH 5.0下存储25C, (b) pH 6.5下存储25C, (C) pH 5.0下存储4C, (d) pH 6.5下存储4C。
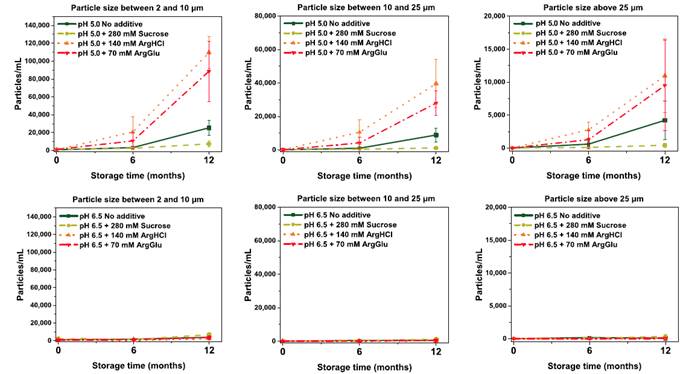
研究了pH和添加剂对PPI13在25C下储存12个月的亚可见粒子的影响。
在这项研究中,我们采用正交高、中通量技术来探讨280nM 蔗糖、140mMArgHCl和70mMArgGlu对一种名为PPI13的单克隆抗体的稳定性的影响。我们在各种参数之间找到了良好的一致性,表明在低离子强度条件下,蔗糖稳定了蛋白质,而在这种浓度下的arginine盐在pH 5.0和6.5之间降低了胶体蛋白的稳定性。这种减少可以通过离子强度的增加和蛋白质单体之间的静电斥量来解释,一旦arginine盐的离子与蛋白质的表面结合,就像我们的STD-NMR实验一样。我们还进行了长期稳定性研究,以验证快速生物物理表征的观察。与长期稳定数据相比较的2个参数是第一个热的变点点的温度,在等温还原后,相对单体产生的温度。PPI13在较低温度下展开的配方,具有低胶体稳定性,是在25摄氏度后12个月储存后形成的大量可见颗粒的配方。我们的工作在两个方面都很重要。首先,它表明了许多生物物理技术所表示的PPI13公式
低物理稳定性也是长期储存中蛋白质聚集的配方。第二,我们表明,arginine盐是否会抑制或促进聚合高度依赖于其他溶液参数,如解决方案的起始离子强度。虽然精氨酸无疑能在短间隔疏水相互作用的配方中带来好处(例如:在高蛋白浓度下,或者在有长期静电排斥的情况下,精氨酸盐对蛋白质胶体的稳定性有一种有害的影响,在蛋白质配方中,静电斥力对抑制蛋白质聚集至关重要。在低离子强度下的稀蛋白溶液中。
相关产品
更多
相关文章
更多
技术文章
2024-10-09技术文章
2024-08-10技术文章
2024-05-30技术文章
2024-05-30
虚拟号将在 秒后失效
使用微信扫码拨号