中国粉体网讯 近日,国家药监局核查中心发布了《化药口服固体制剂中间产品存放时限研究技术指导原则》,如下:
化药口服固体制剂中间产品存放时限研究技术指导原则
一、概述
化药口服固体制剂的中间产品质量作为生产过程控制的关键部分,是药品符合质量标准的重要保证。该类制剂工艺通常包括多个生产工序,因生产安排等原因,可能导致中间产品无法及时进行下一工序生产而需要暂存的情况,药品注册申请人/生产企业在研发及生产过程中应关注中间产品的存放时限研究。存放时限是指中间产品在特定条件下存放并能维持其符合既定的质量标准的时间长度。为进一步加强国际人用药品注册技术协调会质量源于设计理念在实际生产中的运用,提高化药口服固体制剂生产过程中的风险控制水平,明确中间产品存放的相关技术要求,制定本指导原则。
本指导原则适用于化药口服固体制剂,旨在解决制剂工业上关注的化药口服固体制剂在非连续生产时不同生产工序中中间产品需要短暂存贮的问题,以期为药物研发和生产过程中中间产品的存放时限研究提供技术指导和参考。通常情况,当制剂整个生产过程超过30天时,应进行中间产品存放时限研究。当制剂整个生产过程不超过30天时,应通过风险评估决定是否需要进行中间产品存放时限研究。
药品注册申请人/生产企业作为责任主体,应结合产品和生产工艺的特点,对可能影响中间产品质量的因素如包装形式、存放环境(温度、湿度等)等进行风险评估,设计合理的取样计划,选择影响制剂生产及其关键质量属性的项目作为考察指标,提供支持性研究依据以证明存放时限的合理性。
本指导原则仅代表药品监管部门当前的观点和认识,随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则设计和实施研究时,可同时参考药品生产质量管理规范和其他国内外相关的技术文件。
二、主要研究内容
(一)样品要求
中间产品的存放时限研究应至少在中试规模批次中进行,如果研究批量未达到商业化规模,则需承诺在商业化规模(涵盖拟定的生产场地)中进行确认。当产品处方、生产工艺、设备、贮藏条件和包材等发生变更时,可通过风险评估来判定是否需要对存放时限进行重新研究或再次确认。
至少选择一批中间产品来确定存放时限,也可基于物料的特性和其他相关方面,通过风险评估来确定适当的批次。
对于多规格制剂,可以基于风险评估选择代表性的规格来进行研究。
(二)研究对象、考察时间和考察项目
不同产品应结合剂型、生产工艺的特点,对生产过程进行分析,根据需要特殊存贮和生产过程的时间,以及环境和存贮条件的潜在影响确定合理的研究对象。
确定研究对象后,应结合不同生产工序中中间产品的特性和存贮需求,并结合研究对象对后续工艺及制剂关键质量属性的影响,设定不同的考察时间点、时长和考察项目。考察项目应能反映中间产品质量的变化情况,即在放置过程中易发生变化的,可能影响成品质量、安全性和/或有效性的项目,内容通常涵盖物理、化学和微生物学等特性。存放时限研究的持续时间应该涵盖拟定的最长存放时间,考察时间点应至少包括开始、中间和结束时间。
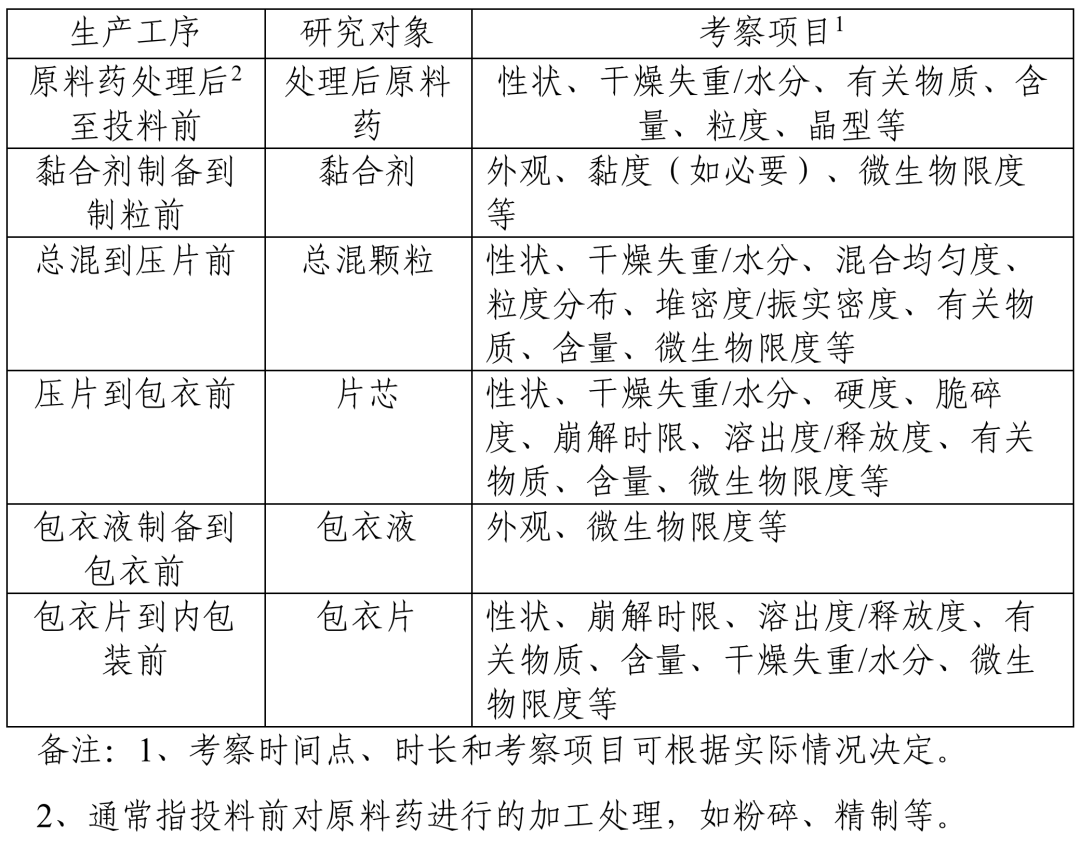
以口服包衣片剂为例,下表列举了相关存放时限的生产工序、研究对象、考察项目(见示例)。本指导原则推荐的生产工序、研究对象及考察项目等并不包括所有生产情况,药品注册申请人/生产企业可根据剂型特点和生产需要并结合产品稳定性情况,依据本指导原则研究思路并基于风险评估进行选择和调整。
示例 口服包衣片剂存放时限生产工序、研究对象、考察项目
(三)研究样品的存放条件
存放条件不应对后续的生产工艺以及中间产品的稳定性、质量、安全性和/或有效性产生不良影响。实际研究中建议制定存放时限的研究方案,研究样品的存放条件应考虑以下内容:(1)样品存放的环境条件应与暂存区域的条件相当,否则应说明其他条件的合理性;(2)样品的暂存容器应与商业化生产样品暂存所用的容器相同,如果在存放时限考察中必须减小容器尺寸,应使用等同的容器(材质相同,使用与生产相同的密闭系统),并进行合理性论证;(3)对于有稳定性风险(如易氧化)的产品,暂存过程中应关注中间产品的容器顶部空间对产品质量的潜在影响,必要时存放时限研究应考虑最差情形时的条件,顶部空间与存放容器容量的比例应至少和常规生产中可能的最大情形相同(特别要考虑未装满容器)。
如果存在跨场地转移,还应考虑转移时间和转移条件,必要时进行加速试验以证明短期偏离存贮条件时的稳定性。
(四)质量标准与分析方法
根据产品特点和质量控制需要合理设定中间产品存放时限研究的质量标准,所采用的分析方法应经过方法学验证并能满足研究的要求。
(五)存放时限的确定
应根据中间产品的稳定性研究结果和实际生产需要拟定合理的存放时限。必要时,应将所获得的数据进行统计学研究,分析变化趋势,以判定各考察项目拟定限度与存放时限设定的合理性。如果中间产品在存放时限研究期间内的研究数据显示有含量降低、降解产物增加等情形,则应考虑对经最长存放时限研究的中间产品制得的成品批次进行加速/长期稳定性试验或者考虑缩短中间产品的存放时限以确保生产出合格的制剂成品。
参考来源:
国家药品监督管理局药品审评中心
(中国粉体网编辑整理/青黎)
注:图片非商业用途,存在侵权告知删除