中国粉体网讯: 可能许多人都曾思考过,药怎么能治病的问题,如:药物怎么知道我哪里病了?它是怎么过去的?它在病灶那里停下?过去之后它是不是没多少效果了?或许后来随着知识的增加知道肠道吸收和血液循环输送等,但是远远不能解答我们的疑问。今天,我们一起来全面了解一下药物传递这个领域中的新贵,介孔二氧化硅,看看这位体内的药物快递小哥是怎么工作的,它如何形成药物传递系统,又有怎样的表现,也顺便找一下前面小问题的答案。
孔二氧化硅纳米颗粒(Mesoporous Silica Nanoparticles,MSNs)是一种重要的形态优越、骨架稳定、强度出色的多孔材料。其具有良好生物相容性、有序介孔结构、比表面积大、表面易修饰性、光致发光性能等特点,在很多生物医药领域显示出了极大的应用前景,尤其是基于MSNs的纳米药物输送体系被广泛用于各种药物的递送。
本文将对其当前研究进展、结构特点、合成方法和种类进行介绍。并重点展开讲述不同结构的介孔二氧化硅药物传递系统,不同刺激响应性的药物递送系统,以及药物递送效率的影响因素等多点内容。希望,与大家一起了解介孔二氧化硅在医药领域的广泛应用和巨大潜力。
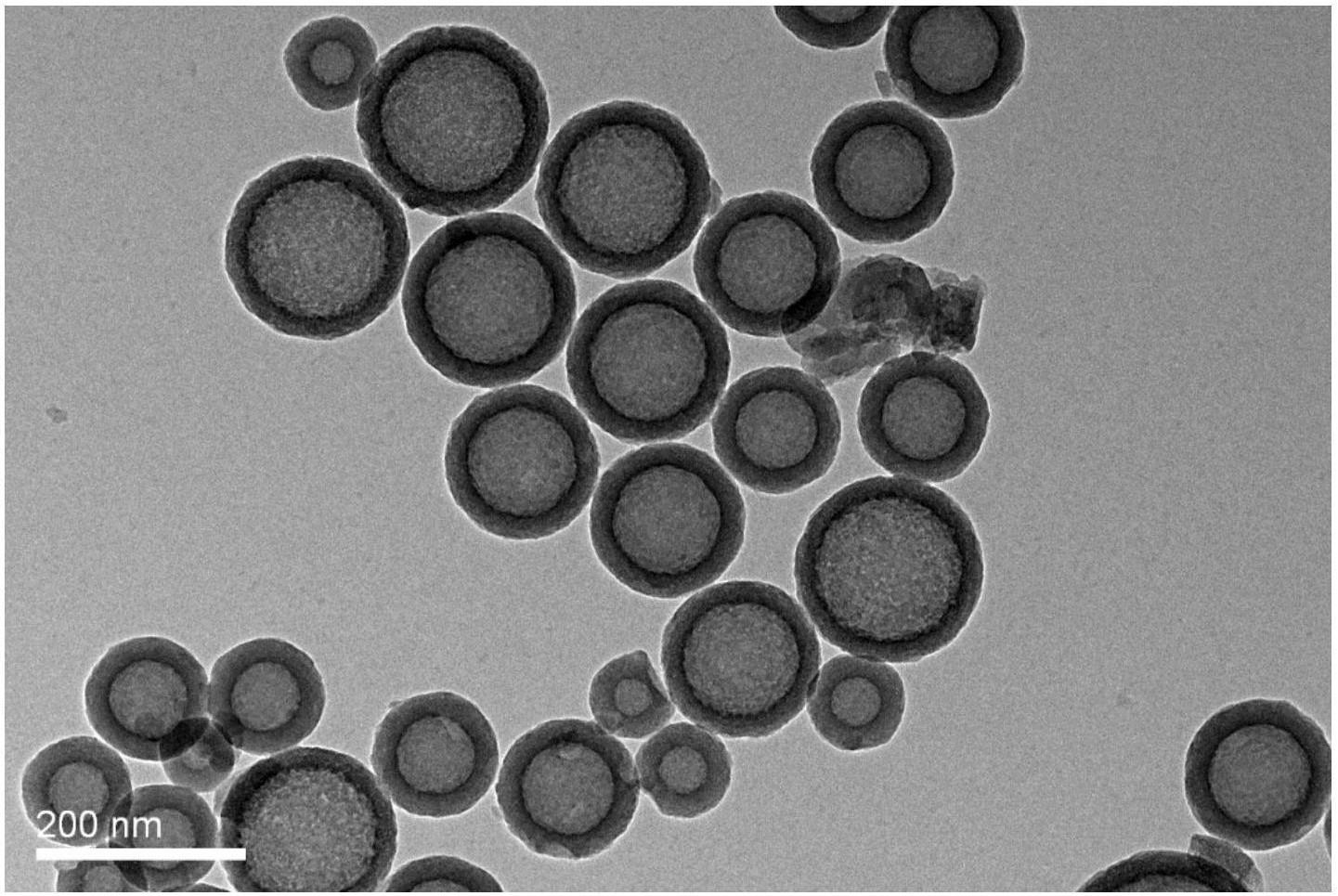
中空介孔二氧化硅的TEM图
一、 MSNs的研究进展
纳米制剂与常规药物相比,具有增加药物溶解度、提高药物稳定性、缓释控释药物等多方面优势。介孔二氧化硅因多孔性、比表面积大、便于修饰性、毒性低等特点,得到广泛应用,具有极大的开发前景,但是介孔二氧化硅的载药容积有限,在生物体内代谢慢,装载的药物容易泄漏。科学家在MSNs的基础上进一步扩展,制备出中空介孔二氧化硅纳米粒(HMSNs)。HMSNs的空腔与介孔结构极大地增大了载药容积,药物装载量得到了有效提升,更可贵的是,中空介孔二氧化硅特殊的双层结构能实现亲疏水性两种不同性质的药物的共包封,为药物的联合治疗提供了新思路。随后出现的膜包被技术使科研工作者能够在阻止药物泄漏等问题上进行多种有益尝试。
上世纪90年代,MSN被广泛应用于分子筛。2001年,Vallet-Regi等首先将MCM-41(介孔二氧化硅的一种)用作药物载体在药物传递系统中应用。此后,对介孔材料在生物医药学的研究有了显著的增加。除了MCM-41,其他结构的介孔二氧化硅材料如SBA-15和MCM-48也被作为载体用于药物传递系统的研究。SBA-15的孔径大约在4~10nm的范围内,而MCM-41的孔径比较小,一般在2~4nm的范围内。MSN具有巨大的比表面积、可调的介孔孔径、结构稳定、易于修饰、生物相容性好等一系列优点成为理想的药物载体材料。
二、 MSNs的结构特点
介孔二氧化硅材料的主要特征是具有规则的多孔结构,孔径均匀排列,并且孔径之间彼此独立,同时具有很高的比表面积(>900m2/g)和孔容积(>0.9cm'/g)以及较高的热稳定性,其孔径大小也可以从几纳米到十几纳米范围内进行控制。由于介孔二氧化硅材料含有许多硅羟基,所以可以对其表面和介孔孔道进行不同官能团的修饰,以扩大其应用范围。
三、MSNs的合成
1、制备方法介绍:
当前的介孔二氧化硅材料的合成方法主要是基于使用表面活性剂作为结构导向剂,合成方法包括溶胶-凝胶法、水热合成法、微波合成法、模板合成法、改进的气凝胶法、快速自组装等。其中,基于溶胶-凝胶法的模板合成法因其反应条件温和、操作便利成为了目前最为常用的方法。其根据模板的种类和原理又可分为软模板法和硬模板法。
2、可降解MSNs与其制备方法
另外,一般的MSNs不易被代谢,研究发现MSNs在体内需要4周才能被清除完全,机体若来不及将其代谢完全,容易在肝和脾内过多堆积,对组织器官造成一定损伤。可降解的MSNs作为新颖且前景光明的载药工具应运而生。Shen等制备的可降解的MSNs在递送药物后,在体内一段时间内能够被快速清除,避免了纳米粒在体内的过多堆积造成组织器官的损伤。而且,其制备方法也相当新颖:以十六烷基三甲基氯化铵(CTAC)为模版胶束,TEOS环己烷溶液在油水界面(油相在上,水相在下)水解形成MSNs,再用硝酸铵乙醇溶液萃取除掉CTAC即得。
可降解的MSNs在模拟生理条件的Krebs溶液中会随着时间的延长而逐渐从外向内降解,在4d后,MSNs纳米粒消失,降解完全。可降解的MSNs在制备过程中可以通过控制反应时间来控制纳米粒的尺寸,调节TEOS的量或油相的种类来调节孔径的大小。可降解的MSNs不仅材料尺寸、孔径可调,其独特的可降解性进一步优化了载体,使其在疾病的诊断与治疗方面得到更好的应用。
四、 介孔二氧化硅药物递送系统
鉴于介孔二氧化硅制备方式和结构的不同,出现了不同结构的介孔二氧化硅药物递送系统。在实际应用中,鉴于药理、病理的不同,可以根据多方特点灵活选择。
1、 MCM结构的介孔二氧化硅
MCM是mobil composition of matter的简称。MCM系列的介孔二氧化硅主要是美孚石油公司以硅酸乙酯为硅源通过胶束软模板法合成。在MCM系列中,针对MCM-41的研究最为普遍。MCM-41具有由规整的圆柱形介孔排列而成的一维孔道结构孔径可以在2.0~6.5nm之间调节。正是由于具有这种有序可控的孔道结构,MCM-41可以使药物均匀地装载并实现药物的有效递送。
Qu等利用MCM-41系统作为水溶性药物卡托普利的载体,发现其可以使药物缓慢可控地释放。Mathew等利用N-[3(三甲氧基硅基)丙基]苯胺和苯基三甲氧基硅烷修饰的MCM-41来用作难溶性药物的载体。Rakhshaei等将掺入氧化锌的MCM-41作为药物载体,并与羧甲基纤维素水凝胶组合制备形成了柔性纳米复合水凝胶膜再用四环素研究了纳米复合水凝胶膜的药物递送性能,结果显示四环素可以持续可控地释放。
MCM-48是MCM体系中另一类重要的介孔二氧化硅材料。与MCM-41的单向孔道不同,MCM-48具有两套相互独立的三维立方螺旋孔道网络结构,因而具有比MCM-41更高的吸附动力学参数,且传质更快。
2、 SBA结构的介孔二氧化硅
SBA是santa barbara amorphous的简称。SBA系列的介孔二氧化硅是利用嵌段型表面活性剂通过软模板法来合成,具有高度有序的六边形结构,孔径在5~ 30nm范围内可调。其中,研究较为广泛的是SBA-15。由于其孔壁较厚,相对于MCM系列材料来说,SBA-15的水热稳定性更好,且SBA-15的孔径通常大于MCM-41的孔径这对药物分子体积的限制作用会更小。
Wang等分别用SBA-15以及氨丙基修饰的SBA-15作为黄芩苷的药物载体其中药物的负载量分别为36.3%和39.1%(质量分数),药物的释放量则分别为72.2%和98.4%。类似地,Eren等用氨丙基修饰的SBA-15以及硼掺杂的SBA-15作为难溶性药物塞来昔布的载体,结果表明:前者可以使药物缓慢可控地释放,而后者则表现为突释。这均揭示了药物释放行为高度依赖于SBA-15不同的表面性质。近期Cussa等利用SBA-15作为镇痛药酮咯酸氨丁三醇的药物载体,显著改善了该药的控制释放行为并增强了镇痛效果。
3、HMS结构的介孔二氧化硅
HMS,一种中空介孔材料。HMS可以通过软模板法或硬模板法来合成其具有可调的孔径和中空空隙。与传统的介孔材料相比,其在药物递送和扩散方面表现出更多的优势。
Zhu等报道了利用HMS作为布洛芬的药物载体。将HMS的药物吸附量与MCM-41进行比较,结果表明,HMS具有比MCM-41更大的药物吸附量。进一步使用阿司匹林作为模型药物研究结果也表明,由于HMS具有较高的比表面积和中空结构在HMS中阿司匹林的吸附量高于常规的MCM-48和MCM-41。同时,他们发现HMS、MCM-48和MCM-41作为阿司匹林的药物递送系统,在体外释放过程中同样具有持续释放的特性,并遵循Fickian扩散机制。
Li等利用金纳米颗粒和十六烷基三甲基溴化铵作为双模板合成了一系列壳厚度可调的HMS,并将其作为多柔比星的药物载体研究了体外释药行为。结果发现:通过调整壳层的厚度,可以灵活方便地控制HMS中药物的释放。Fu等和Yang等则在HMS表面修饰多种基团使其成为多功能智能响应性药物载体。
如上所述,由于可控的孔径、高的比表面积以及表面易修饰的特性,多种介孔二氧硅体系均可以作为良好的药物递送系统。
五、介孔二氧化硅刺激响应性药物递送系统
经研究,介孔二氧化硅的诸多理化特性在药物递送系统中被不断挖掘和应用。其中,介孔二氧化硅对不同传递环境的不同刺激相应特性被重点应用,整个药物传递系统也得到持续拓展,因此在临床中面对许多疾病也都了有不同的药物传递手段和治疗思路。
1、pH响应性的药物递送系统
迄今为止,研究者已经开发出了多种pH响应性的药物递送系统。生物体内pH的变化主要来源于以下两点:与正常组织相比,肿瘤部位的pH为5.8~7.6;人体整个胃肠道的pH范围较为广泛,胃内的pH为1.0~3.0,小肠内的pH为6.5~7.0,而结肠的pH为7.0~8.0。因此,基于酸性pH响应的药物递送系统可以靶向地控制药物释放到肿瘤部位。
Fisher等利用Al-MCM-41和荧光素作为模型首次研究了pH变化对药物分子释放的影响。近年来,Li等利用两种不同功能化的β-环糊精,通过疏水相互作用与MCM-41连接,将抗菌药物莫西沙星封装在孔道中。当pH降低时,功能化的环糊精发生质子化解离而使药物释放出来。Cheng等将D-α-琥珀酸生育酚聚乙二醇酯与聚多巴胺官能化的介孔二氧化硅作为pH响应性的药物递送系统用于可控地递送多柔比星来治疗非小细胞肺癌。Rim等则利用可吸收的磷化钙(CaP)包被的介孔二氧化硅作为pH响应性药物递送系统。当pH较低时,CaР溶解使封装的药物更容易地释放出来。Li等设计合成了一种以金纳米粒子为核心、碳介孔二氧化硅为外壳的中空纳米胶囊,进一步将多柔比星装载在纳米胶囊中形成了复合的药物递送系统。由于pH的变化,药物分子和纳米胶囊间的范德华力发生改变而使药物释放出来。Kienzle等介绍了一种新型的树突状介孔二氧化硅并使其作为肿瘤坏死因子α(TNF-a)的 pH响应性递送系统。
3、 氧化还原响应性药物递送系统
利用氧化还原反应介导药物释放是刺激响应性药物递送系统中的又一实例。二硫键易于与各种还原剂发生反应,因而具有敏感的氧化还原特性可以作为氧化还原响应性药物递送系统的作用位点。
Xiao等将富含色氨酸的支链肽通过二硫键与介孔二氧化硅连接而使药物封装在孔道中。一旦其被吞入癌细胞中胞内高浓度的谷胱甘肽会使二硫键断裂,支链肽脱离,促使药物从孔道中释放出来。Wu等成功合成了一种中空介孔有机硅,并通过二硫键在其上连接聚β-氨基酯作为siRNA以及多柔比星的氧化还原响应性药物递送系统。Palanikumar等通过一锅法合成了聚合物连接的介孔二氧化硅合成过程中添加含有硫醇的配体分子,使负载在孔道中的药物分子可以通过胞内的还原性微环境靶向释放。类似地Zhang等通过一锅法合成了含有二硫键的介孔二氧化硅作为多柔比星的氧化还原响应性药物递送系统。
3、温度响应性药物递送系统
在刺激响应性药物递送系统中除pH和氧化还原响应外另一种常见的刺激响应方式是温度响应。其中将连接有聚N-异丙基丙烯酰胺(pNIPAM)的介孔二氧化硅作为温度响应性复合药物递送系统的研究最为普遍。pNIPAM是一种理想的温度敏感性聚合物其可以在低临界溶解温度(LCST)(约32℃)下完成亲水性到疏水性的转变。介孔二氧化硅与pNIPAM复合材料主要通过以下原理来实现温度响应。首先将pNIPAM 聚合物沉积在介孔二氧化硅的孔内或表面。在LCST以下时由于pNIPAM分子链溶胀阻塞孔道,且pNIPAM和药物分子间可以形成氢键,能够防止药物从孔道中释放。在LCST之上时,聚合物转变为疏水性并收缩,导致孔道的开放和氢键的断裂,进而使药物分子释放出来。Ugazio等利用介孔二氧化硅与pNIPAM复合材料作为柚皮素的温度响应性药物递送系统,并将其应用在皮肤病治疗方面。Bathfield等则直接将pNIPAM和硅源混合,一步合成了温度响应性的药物递送系统,该方法简单又快捷。
Ruiz-Hernandez等和Schlossbauer等探索了一种新型的基于DNA热响应性药物递送系统其中DNA/磁性纳米颗粒和生物素标记的DNA能够覆盖介孔二氧化硅的孔道。在特定的DNA解链温度下,DNA双链打开使孔道开放,从而释放装载在孔中的模型药物。
4、光响应性药物递送系统
光也是刺激响应性药物递送系统的一种刺激因素。Ferris等报道了在MCM-41中装载偶氮苯衍生物从而开发了光响应性药物递送系统。偶氮苯及其衍生物在紫外-可见光下可以发生可逆性转变。在可见光下,偶氮苯衍生物为反式结构,可以与β-环糊精结合而阻止MCM-41孔道中药物的释放。在300~380nm光照射下,它的结构从反式转变为顺式,而从β-环糊精上解离下来,MCM-41孔道中药物得以释放。因此,偶氮苯及其衍生物能够对药物释放具有光响应性。
类似地Li等合成了内核为金纳米粒子、外壳为碳—二氧化硅的复合纳米胶囊,用以装载多柔比星,结果表明该复合体系能够实现药物对NIR响应性的靶向释放。Liu等则制备了外层连接单壁碳纳米管的介孔二氧化硅作为多柔比星的NIR响应性药物递送系统。
5、超声响应性药物递送系统
超声波具有非侵入性、无电离辐射等优点,且可以通过调谐频率、占空比和超声时间来调节组织穿透深度,可作为药物可控释放的外部刺激因素。
在Kim等的研究工作中,他们利用聚二甲基硅氧烷-介孔二氧化硅复合材料来装载布洛芬,使其可以在超声刺激下释放。Paris等开发了一种新型的温度-超声双重响应性药物递送系统。他们将一种温度响应性和超声响应性的共聚物接枝在介孔二氧化硅表面上。在4℃时,温度响应性聚合物为亲水性,药物分子可以扩散到开放的孔道中。在37℃时其则转变为疏水性阻止药物分子进出孔道。然而,在超声波的作用下,超声响应性疏水聚合物四氢吡喃甲基丙烯酸酯可以被水解为亲水性的甲基丙烯酸极性的变化会引起孔道的开放进而使药物分子释放出来。Lv等合成了介孔二氧化硅与微泡复合材料来作为超声响应性的药物递送系统。他们利用表面修饰叶酸的介孔二氧化硅装载丹参酮IIA并将其封装在气体填充的微泡中在超声波的刺激下,微泡破裂而使药物释放出来。
六、介孔二氧化硅载体中药物递送效率的影响因素
作为药物载体,介孔二氧化硅中的药物递送的效率必然是研究和应用的焦点,不过其效率受载体孔径、孔结构类型、比表面积等多方因素影响,在各种情况下有不同的递送效率。
1、孔径
一般情况下药物的吸附是将高度浓缩的药物溶液浸泡在介孔二氧化硅基质中来实现的,而该方法主要依赖于基质的吸附性能。基质的孔径决定了可吸附到孔道中药物分子的大小。孔径的减小必然会导致药物吸附量及释放速率的降低,这与空间位阻效应相关联。
Vallet-Regi等使用不同链长的表面活性剂十二烷基三甲基溴化铵(C12TAB)和十六烷基三甲基溴化铵(C16TAB)制备得到不同孔径的MCM-41,并将其作为布洛芬的药物载体,结果显示:使用C16TAB获得的具有较大孔径的MCM-41药物递送系统,体外释药24h后约有68%的药物被释放出来。相比之下,用C12TAB获得的MCM-41在同一时间段内仅释放了55%的药物。
同时,研究结果表明用以吸附药物的MCM-41初始状态不同对药物的释放行为也有一定的影响。进一步的研究也证实了介孔二氧化硅的孔径是影响药物释放速率的关键因素之—。当MCM-41药物递送系统的孔径在2.5~3.6nm时,药物释放速率会随孔径的增大而显著增加。类似地,Jia等通过控制反应时间合成了3种不同孔径的介孔二氧化硅,并将其作为紫杉醇的载体研究了药物的体外释放行为,发现了药物的释放速率依赖于孔径的大小。
2、比表面积
大量研究已经表明,比表面积是影响亲水性及多含官能团药物分子吸附量的重要因素。具有更多硅羟基的介孔二氧化硅能够提供更多的活性位点,从而增加了药物吸附量。Azais等合成了BEI比表面积分别为987和775m2/g的MCM-41。两者在相同的条件下吸附布洛芬的量分别为670和600mgl/g,这表明了药物吸附量会随着比表面积的增加而增加。
3、孔容
药物与介孔的相互作用是表面吸附用,然而药物与药物之间的静电相互作用可能会导致孔道的堵塞。因此,孔容亦是影响药物吸附量的重要内素。简而言之,孔容越大,药物的吸附量越高。一有研究表明,孔容分别为1.18和0.28㎝3/g的MCM-41对卡托普利的吸附量可以达到33.99%和23.60%(质量分数)。因此,孔容是影响药物吸附量的另一个重要因素。
4、孔结构类型
介孔二氧化硅的孔结构类型对药物的吸附和释放也有一定的影响。已有研究表明相互连通的孔道类型能够提供更为通畅的通气过程。具有三维立方连通孔道的SBA-1与具有相似孔径和比表面积而无连通孔道的SBA3相比,SBA-1具有更快的药物释放速率。
另外,研究还表明,相对于其他类型的孔结构笼状―维结构的孔道能够提供更高的药物吸附量以及更缓慢的药物释放速率。Kjellman等分别利用有无微孔的SBA-15作为疏水性药物达沙替尼的载体,并研究了它们的体外释放行为结果显示:具有微孔的SBA-15体外释药行为更为理想,在初始状态,药物释放速率较高之后则保持在一定的水平范围。这可能是由于微孔的存在能够使难溶性药物以单个分子的形式被限制在孔道中,进而使药物可以稳定地释放。然而,当无微孔存在时药物更容易结晶成稳固的且不易溶的水合物形式从而导致药物的释放速率随着时间的推移而降低。
5、表面官能化
通常情况下药物分子通过弱的非共价相互作用(如氢键、物理吸附和静电相互作用)与介孔二氧化硅相结合。因此,采用适当的官能团对其进行修饰可以改善药物的吸附和释放性能。Mortazavi等用3-氨丙基三乙氧基硅烷改性后的MCM-41作为布洛芬的药物载体,结果表明:由于改性后的MCM-41与药物形成了较强的共价键,使得药物释放速度减缓,从而实现药物的可控释放。Bouchoucha等用磷酸酯硅烷对介孔二氧化硅进行表面修饰发现其可以更好地控制带正电荷药物的吸附和释放。
6、壳层厚度
对于中空介孔二氧化硅而言,壳层的厚度也会影响药物的释放行为。在相同时间内随着壳层厚度的减小,药物的释放百分量明显增加,而空心尺寸的变化则对药物释放量的影响较小。这主要是由于HMS的壳层越薄,其对药物扩散的限制能力越弱,药物的释放百分量显著增加。但空心尺寸的变化并不会影响药物的扩散能力,不同空心尺寸的HMS药物释放百分量基本相同。因此,药物的释放行为主要受壳层厚度的影响。
综上所述,在介孔二氧化硅药物递送系统中,载体对药物的吸附和释放性能是衡量药物递送效率的重要指标。药物的递送效率主要与介孔二氧化硅的孔径、孔容、比表面积、孔结构类型及表面官能化有关。孔径和孔容主要通过空间位阻来影响药物的吸附与释放。而比表面积和表面官能化则主要通过增加活性作用位点以及药物与介孔二氧化硅的相互作用力来增加药物的吸附量。孔道的结构类型在一定程度上也会影响药物的吸附和释放。此外,对于中空介孔二氧化硅而言,其壳层的厚度会影响药物的扩散能力进而影响药物的释放性能。
七、MSNs的药物释放
随着对治疗水平要求的提高,人们希望药物在到达病灶部位前实现“零释放”,并且不被机体代谢掉,而在病灶部位实行定点释放。但MSNs在载药和药物递送过程中药物容易泄漏,纳米粒容易聚沉,最终造成给药剂量不准,达不到实验效果,并且释放的药物可能产生毒副作用。随着研究的深入,基于环境响应性的药物控释逐渐成为研究的热点。
1、膜包被MSNs缓释药物
膜包被MSNs是近些年来开发纳米载体的新技术,磷脂作为细胞膜成分具有良好的生物相容性,包被的MSNs具有更好的稳定性,并且能达到缓释药物的效果。目前,科学家正探索着用细胞膜包被MSNs,利用不同细胞膜表面的特性发挥更加深远的作用。通过旋膜法制备磷脂包被的MSNs,在MSNs表面裹有一层致密磷脂,阻止了药物的泄漏,更是提高了纳米粒的生物相容性,MSNs在体内也能够长循环。Liu等对磷脂包被MSNs作了深入研究,利用MSNs与磷脂表面电性差异,通过静电作用共孵育制得MSNs。在透射电镜下可以看到MSNs表面包被着一层约5.5nm厚度的磷脂层。脂包被MSNs防止药物泄漏并不是唯一的方法。用细胞膜作为运输载体越来越多的被关注与研究,与磷脂相似的红细胞膜也可以用来包被MSNs,红细胞膜包被的MSNs能躲避巨噬细胞的吞噬,使药物在体内能够长循环,也能增加树突状细胞对纳米粒的摄取,引发免疫效应。Xuan等研究巨噬细胞膜包被的MSNs在透射电镜下可以清晰的看到MSNs外层的巨噬细胞膜结构。纳米粒在体内能阻止内皮网状系统的摄取,促进药物长循环,膜上的蛋白有靶向肿瘤部位的功能,负载化疗药物的MSNs有效的抑制了肿瘤生长。
2、堵孔MSNs阻止药物泄露与环境响应性释放
MSNs表面易修饰性不仅能使药物靶向到病灶部位,还可以利用修饰上的基团堵住MSNs的介孔,阻止药物突释,甚至能利用病灶部位的特殊环境实现药物的定点释放。装载在孔道里的药物容易从孔道里泄漏出来,而MSNs表面修饰的苯硼酸,再与β-环糊精通过硼酸酯键连接,β-环糊精就能堵住MSNs的孔,将药物封闭在介孔内。苯硼酸酯在酸性或糖溶液中容易水解,通过调节药物释放环境中的酸度与糖浓度,可以实现药物的可控释放,对于糖尿病与肿瘤的治疗有一定的借鉴性。修饰上苯硼酸的MSNs还可以通过中间体功能化多肽(由聚阳离子细胞穿透肽-多聚精氨酸和基质金属蛋白酶2底物肽两部分组成)与人体血清白蛋白(HSA)共价连接。HSA密封于MSNs表面,阻止了药物分子的泄漏。药物释放依赖于肿瘤部位过表达的基质金属蛋白酶2的作用,HSA酶解,从而靶向释放药物。通过双硫键接上RGD多肽的载药MSNs主动靶向肿瘤部位也能起到很大的效果,并能实现谷胱甘肽(GSH)还原敏感性释放。
结语
MSNs作为药物递送载体,以安全性、高载药量著称,在生物医药领域展现出极大的应用前景。HMSNs的特殊结构对亲疏水药物的共包封,甚至对3种药物的共包封,将化疗与多种抗肿瘤手段联合,在治疗肿瘤方面开辟了新途径。可降解的MSNs已能成功制备,增加了给药剂型的安全性,目前对易降解的HMSNs的研究与应用也在不断加强,不断优化药物载体,加强其细分应用,这是需要花费大量时间和精力的大课题。
唐佳民,等:介孔二氧化硅纳米粒的研究进展,现代药物与临床
崔妍,等:介孔二氧化硅在药物递送系统中的研究进展,北京化工大学
郭秀丽,等:功能化介孔二氧化硅复合微球的制备及载药研究,河南大学
注:图片非商业用途,存在侵权告知删除!