贝克曼库尔特商贸(中国)有限公司
 白金会员
白金会员 已认证
已认证

贝克曼库尔特商贸(中国)有限公司
 白金会员
白金会员 已认证
已认证
摘要
小球藻因其高蛋白质含量和与世界卫生组织(WHO)推荐的人类营养素相似的氨基酸谱,以及富含人体必需营养素,广泛应用于食品和饲料工业领域1。此外,小球藻在不利的生长条件下可积累C16和C18脂肪酸2,3,为污水处理厂生产生物燃料提供了可能1。
我们将为您展示搭载LAM的BioLector XT高通量微型生物反应器,适用于小球藻的光自养培养。此外,专门设计并验证的滤光片模块支持多种关键培养参数的在线监测。

概述
通常,小球藻是通过摇瓶在有限的实验通量下进行培养。培养条件优化、藻株筛选和藻株工程是商业化的三大关键步骤4,例如,通过缩短叶绿素天线尺寸以最大限度地提高太阳能-产物能量转换效率5。基于微孔的培养设备为微生物和哺乳动物细胞早期快速筛选提供了一种强大的工具6,并已成功应用于异养微藻生物工艺开发7。
微型光照生物反应器(μPBR)系统,可用于研究自养或混合营养培养条件,但目前的概念离系列技术还很远,进一步的改进——尤其是可调节照明——是必要的8,9。
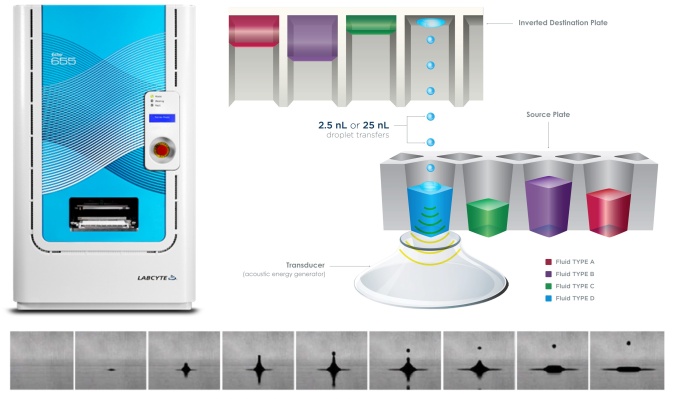
搭载精密光照模块的BioLector XT高通量微型生物反应器,可在多达48个微孔中同时进行光营养培养。通过专门设计的滤光片模块,可实现非侵入式、实时在线监测关键培养参数如生物量、叶绿素浓度和pH值。光照模块(LAM)在光合光谱范围内提供精确、多样化的光照方案。其光谱的灵活性是通过16种不同的LED实现的,每一个LED都可以单独控制,可提供近4000 μmol/m2/s的最大辐射。
方法
滤光片模块开发
经专门设计并测试的滤光片模块,可用于在线监测多种重要的光营养培养参数(生物量、叶绿素含量和pH值)。
小球藻
无菌小球藻(SAG藻株编号211-11b)由哥廷根大学藻种保藏中心提供。
培养基
在pH值为6.5的改良Bold基础培养基(enBBM)中进行培养10-13。
在摇瓶中预培养
将小球藻置入振幅为50mm的摇瓶中,在25℃培养箱中以180rpm振速进行预培养。为实现光营养生长,在培养室的一侧安装LED模块,同时在摇瓶口使用棉塞,方便气体出入培养液。LED模块由8个平行安装的模拟太阳光LED灯条组成(LUMITRONIX LED-Technik GmbH)。将辐照度设置为200μmol/m2/s,使之与BioLector XT微型生物反应器培养时的辐照度一致。
在BioLector XT微型生物反应器中培养
采用Flowerplate梅花板[M2P-MTP-48-B]进行光营养培养,初始细胞密度为5.5*106个细胞/mL,培养体积为1mL。用透气性密封膜(MTP-F-GPRS-48-10)密封微孔板,方便光合作用期间二氧化碳和氧气的交换。照明模块设置为提供400~700nm的类太阳光谱,光子通量密度约为200 μmol/m2/s(图1)。
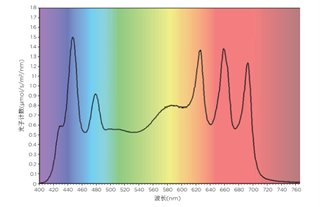
图1. 培养期间的照明光谱和辐照度
将培养参数设置为800 rpm、25℃和85% 的相对湿度,并按10 mL/min流速充入空气和 2% 的CO2混合物。
结果
滤光片模块校准

图2.滤光片模块校准结果图组
生物量
经专门开发的730、750和850 nm生物量滤光片模块,可在0.3≦OD750≦25范围内显示出卓越的校准效果,730 nm模块校准结果如图2.A所示。此外,使用叶绿素a和叶绿素b标准品,未发现叶绿素干扰。
叶绿素含量
叶绿素校准结果显示,经专门设计的滤光片模块可单独或同时检测叶绿素a和叶绿素b,如图2.B所示。
叶绿素荧光常用于测定光营养培养物的生物量14,15。因此,使用生物量系列稀释液进行校准,应用指数递减拟合时,在低生物量浓度下可观察到极佳的分辨率如图2.C所示。校准结果证实,叶绿素荧光滤光片器可准确测定生物量浓度,特别是在生物量浓度较低的时候。
pH值
分别在25、30、35和40℃下,使用含0.1 mg/L HPTS的pH 5~10缓冲溶液(Merck, Darmstadt, DE)对pH滤光片模块进行校准。校准结果出色(图2.D),证明所该设置适用于在线准确测定pH值。
为确保拟定方法对光漂白不敏感,我们在BioLector XT微型生物反应器中使用无接种物enBBM在200μmol/m2/s典型培养条件进行培养实验(图2.E)。实验开始后,CO2浓度的增加使培养基迅速酸化(~0.05pH),但在之后的130小时内,测量值(图2.E)始终保持恒定。这一点证明,在连续光照的培养条件下,使用HPTS测定pH,可连续多日保持准确、稳定的测量水平。
在BioLector XT微型生物反应器中并行光营养培养
经过对滤光片模块进行验证之后,我们开始长期培养,并使用四个滤光片模块进行在线监测:730nm的散射光模块,叶绿素荧光滤光片模块(λex=450nm;λem=700nm)和两种HPTS滤光片模块进行比值pH测定(图3)

图3. 搭载光照模块的BioLector XT微型生物反应器,为期16天的培养中所监测的散射光、叶绿素和pH值
如图3所示,为期16天的培养监测中,生物量浓度持续增加,直至CO2供应被关闭。图中可观察到五个不同的生长阶段:
首先是滞后的指数生长期(i.),之后是三个不同的线性生长期(II.至IV.),最后是CO2耗尽后进入的死亡阶段(V.)。pH和叶绿素信号的变化过程与观察到的生长阶段相关。在整个实验过程中,散射光信号的平均变异系数为5.2%,因此可在建议的设置中进行平行光营养培养。离线样本验证了在线信号的准确性。235小时后采样(此时由于短暂暴露于大气中的CO2浓度中,pH值升高),离线OD750值为40,离线pH值为7.3,这与在线测定的pH值7.2高度一致。在实验结束时,离线OD750值为60左右,表明在实验过程中培养物生长旺盛导致产生较高的生物量浓度。
结论
光照模块的加入为BioLector开创了全新的应用领域。本文应用案例中所介绍的几种滤光片模块,可准确监测关键的光营养培养参数,如生物量浓度、叶绿素含量和pH值。
叶绿素荧光滤光片模块在低浓度生物量测定中具有良好的分辨率,与在高细胞密度下准确的散射光测量相得益彰16。此外,研究证明,基于HPTS的pH测定法是替代optode测量的理想解决方案,即便在连续照明的条件下,该方法也同样适用。
小球藻的长期培养证实,BioLector系统可用作并行、高通量培养的微升级光照生物反应器。此外,经专门设计的滤光片模块可评估培养物生长的在线信息,并揭示不同的生长阶段。
这些结果证实该平台可通过不同方式优化各种应用的光营养培养。精心设计的光照模块,支持在不同照明条件下设置较宽的光谱和辐照度范围,以便优化照明条件。多篇文献已报道这些照明特性可影响藻类生长9,17-21。
在BioLector XT中,可通过气体流量和气体成分改变实验的气体培养条件,这是光营养培养中的一个重要参数,例如,CO2富集可获得更高的生物量浓度1,19。其他影响微藻培养的关键因素包括温度22,23、pH1,20、盐度24、碳源25-27、氮源19,27和培养基成分28。BioLector XT可优化所有这些参数。此外,建议采用分批补料培养来提高脂质产量29。由于监管限制,有关基因工程藻株潜力的研究和应用极少,但藻株经基因改造,可能具有更高的生长速率和细胞密度,更高的生产速率或滴度,更强的鲁棒性或更好的太阳能-生物量转换效率和光合生产力30,5,31,32。
所有这些因素均可通过搭载LAM的BioLector XT微型生物反应器进行研究和优化,助力研究人员加快研究进程,为实现藻类潜能所需的答案提供帮助。
参考文献:
1. Ru, I.T.K., et al., Chlorella vulgaris: a perspective on its potential for combining high biomass with high value bioproducts.Applied Phycology, 2020. 1(1): p. 2-11.2. Yeh, K.-L. and J.-S. Chang, Effects of cultivation conditions and media composition on cell growth and lipid productivity ofindigenous microalga Chlorella vulgaris ESP-31. Bioresource technology, 2012. 105: p. 120-127.3. Maruyama, I., et al., Application of unicellular algae Chlorella vulgaris for the mass-culture of marine rotifer Brachionus, inLive Food in Aquaculture. 1997, Springer. p. 133-138.4. Chisti, Y., Constraints to commercialization of algal fuels. Journal of biotechnology, 2013. 167(3): p. 201-214.5. Melis, A., Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximizeefficiency. Plant science, 2009. 177(4): p. 272-280.6. Ojo, E.O., et al., Design and parallelisation of a miniature photobioreactor platform for microalgal culture evaluation andoptimisation. Biochemical Engineering Journal, 2015. 103: p. 93-102.7. Hillig, F., et al., Bioprocess Development in Single-Use Systems for Heterotrophic Marine Microalgae. Chemie IngenieurTechnik, 2013. 85(1-2): p. 153-161.8. Morschett, H., et al., Laboratory-scale photobiotechnology-current trends and future perspectives. FEMS Microbiol Lett,2018. 365(1).9. Kiss, B. and Á. Németh, High-throughput microalgae cultivation with adjustable LED-module applying different colours forNannochloropsis and Chlorella microcultures. Acta Alimentaria, 2019. 48(1): p. 115-124.10. Bischoff, H.W. and H.C. Bold, Some soil algae from Enchanted Rock and related algal species. 1963, Austin, Tex.: Universityof Texas.11. Bold, H.C., The Morphology of Chlamydomonas chlamydogama, Sp. Nov. Bulletin of the Torrey Botanical Club, 1949. 76(2):p. 101-108.12. Andersen, R.A., Algal culturing techniques. 2005, Burlington, Mass.: Elsevier/Academic Press.13. Morschett, H., W. Wiechert, and M. Oldiges, Accelerated Development of Phototrophic Bioprocesses: A ConceptualFramework. 2017, RWTH Aachen University.14. Wiltshire, K.H., et al., The determination of algal biomass (as chlorophyll) in suspended matter from the Elbe estuary andthe German Bight: A comparison of high-performance liquid chromatography, delayed fluorescence and promptfluorescence methods. Journal of Experimental Marine Biology and Ecology, 1998. 222(1): p. 113-131.15. Ramaraj, R., D.D. Tsai, and P.H. Chen, Chlorophyll is not accurate measurement for algal biomass. Chiang Mai Journal ofScience, 2013. 40(4): p. 547-555.16. m2p-labs GmbH, Baesweiler Germany, The scattered light signal: Calibration of biomass. 2015.17. Carvalho, A.P., et al., Light requirements in microalgal photobioreactors: an overview of biophotonic aspects. AppliedMicrobiology and Biotechnology, 2011. 89(5): p. 1275-1288.18. Johnson, T.J., et al., Photobioreactor cultivation strategies for microalgae and cyanobacteria. Biotechnology Progress,2018. 34(4): p. 811-827.19. Daliry, S., et al., Investigation of optimal condition for Chlorella vulgaris microalgae growth. Global journal of environmentalscience and management, 2017. 3(2).20. Gong, Q., et al., Effects of Light and pH on Cell Density of Chlorella Vulgaris. Energy Procedia, 2014. 61: p. 2012-2015.21. Sforza, E., et al., Adjusted Light and Dark Cycles Can Optimize Photosynthetic Efficiency in Algae Growing inPhotobioreactors. PLoS ONE, 2012. 7(6): p. e38975.22. Serra-Maia, R., et al., Influence of temperature on Chlorella vulgaris growth and mortality rates in a photobioreactor. AlgalResearch, 2016. 18: p. 352-359.23. Converti, A., et al., Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsisoculata and Chlorella vulgaris for biodiesel production. Chemical Engineering and Processing: Process Intensification,2009. 48(6): p. 1146-1151.24. Minhas, A.K., et al., A Review on the Assessment of Stress Conditions for Simultaneous Production of Microalgal Lipids andCarotenoids. Frontiers in Microbiology, 2016. 7.25. Kong, W., et al., The characteristics of biomass production, lipid accumulation and chlorophyll biosynthesis of Chlorellavulgaris under mixotrophic cultivation. African Journal of Biotechnology, 2011. 10(55): p. 11620-11630.26. Scarsella, M., et al., Study on the optimal growing conditions of Chlorella vulgaris in bubble column photobioreactors.Chem. Eng, 2010. 20: p. 85-90.27. Heredia-Arroyo, T., et al., Mixotrophic cultivation of Chlorella vulgaris and its potential application for the oil accumulationfrom non-sugar materials. Biomass and Bioenergy, 2011. 35(5): p. 2245-2253.28. Blair, M.F., B. Kokabian, and V.G. Gude, Light and growth medium effect on Chlorella vulgaris biomass production. Journalof Environmental Chemical Engineering, 2014. 2(1): p. 665-674.29. Keil, T., et al., Polymer-based ammonium-limited fed-batch cultivation in shake flasks improves lipid productivity of themicroalga Chlorella vulgaris. Bioresour Technol, 2019. 291: p. 121821.30. Hallmann, A., Algae biotechnology–green cell-factories on the rise. Current Biotechnology, 2015. 4(4): p. 389-415.31. Fayyaz, M., et al., Genetic engineering of microalgae for enhanced biorefinery capabilities. Biotechnology Advances, 2020.43: p. 107554.32. Ng, I.S., et al., Recent Developments on Genetic Engineering of Microalgae for Biofuels and Bio-Based Chemicals.Biotechnology Journal, 2017. 12(10): p. 1600644.
最新动态
更多