
步琦实验室设备贸易(上海)有限公司
 白金会员
白金会员 已认证
已认证

步琦实验室设备贸易(上海)有限公司
 白金会员
白金会员 已认证
已认证
喷雾干燥 & 冷冻干燥技术
制备白细胞介素粉体研究
趋化因子是一种小的(8-12 kDa)细胞因子,参与许多病理过程,因此是重要的靶点。它们通常由不同类型的细胞(如白细胞)分泌,并通过与同源 G 蛋白偶联受体的细胞表面结合来介导生物学效应。趋化因子配体和受体有 50 多种,根据其初级氨基酸序列的半胱氨酸残基排列进行分类和命名。
趋化因子可用于(慢性)炎症性疾病、癌症和感染性疾病的治疗应用。目前,市场上有两种基于白介素的产品,即重组白介素-11预白介素(Neumega®)和重组人白细胞介素-2醛白介素(Proleukin®)。Neumega® 是一种由大肠杆菌重组 DNA 技术产生的血小板生成生长因子,可静脉给药。皮下应用的 Proleukin® 是一种淋巴因子,也是通过转基因大肠杆菌的重组 DNA 技术产生的。为了增加储存的稳定性、保持药物的生物活性,Neumega® 和 Proleukin® 都采用冷冻干燥的工艺,制成冻干粉制剂使用。
虽然冷冻干燥(FD)是一种广泛使用的技术,具有多种优点,可以快速、温和干燥,但喷雾干燥(SD)可以缩短工艺周期,并可以在常压下进行加热处理。同时,颗粒的性质,如粒径、固体状态和残余水含量可以通过参数进行调节。这里必须指出的是,蛋白质的变性或/和展开也可能发生在 SD 过程中,SD 过程的放大是复杂和高成本的。SD 的另一个重要挑战是粉体回收率低于 100%,这对于高成本疗法和工艺开发来说是一个问题,特别是放大到最终设备上。
对于白细胞介素,已经有了一些成功的冷冻干燥研究案例。然而,据我们所知,SD 作为一种替代方法尚未被研究过。这项工作的目的是开发一种 SD 工艺,使模型白介素以一种保留白介素结合亲和力和生物活性的方式干燥。为此,我们使用了模型白细胞介素,探索喷雾干燥工艺的潜在可行性,并对比分析冷冻干燥和喷雾干燥工艺对白细胞介素活性影响。
1 材料
在磷酸盐缓冲盐水中提供野生型CXCL8(CXCL8,72个氨基酸,8.4kDa)、CXCL8的突变体(dnCXCL8,66个氨基酸,7.7kDa)等各种试剂。
将蛋白质溶液用PBS稀释至最终蛋白质浓度为1mg/ml,即1% w/w。
冷冻干燥机
喷雾干燥仪:BUCHI B-90 HP

▲ BUCHI B-90 HP
2 实验过程
配方溶液分别采用如下冻干程序(表1)和喷干程序(表2)进行样品制备。干燥后的样品在 4-8℃ 的氩气干燥器中保存 12 周。并进行粉体的物性表征。
表1,适用于所有配方中 FD 程序。箭头表示间隔内的压力或温度增减。
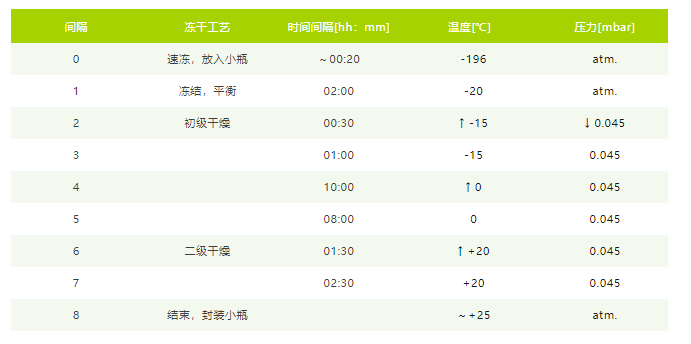
表2,SD 工艺参数及由此产生的过程变量。通过使用纯缓冲液进行测量来确定以 ml/min 为单位的喷射速率。实验过程中喷嘴温度升高,喷嘴温度是在 SD 过程结束时观察到的温度 。

3 实验结果
1、 通过激光衍射分析测定粒径
SD 蛋白粉通过 HELOS 系统的激光衍射分析进行筛选。在 SD 后和第4周、第8周和第12周将粉末直接湿分散在甲苯中进行分析。通过对同一批次 SD 粉的三个样品进行测量,确定了 PSD 分析的标准误差。不分析 FD 粉末的粒度,因为冻干物通常是最终的药物剂型,没有对饼状进行研磨或破碎,只分析了 SD 粉。
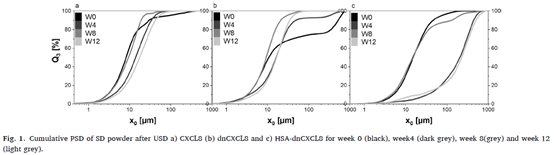
图1 通过激光衍射分析测定粉体粒径,在 10 次超声脉冲后进行测量,SD 粉末的 PSD 随储存时间的变化不大。除了在第0周分析的 SD dnCXCL8 喷雾粉末和在第8周分析的 SD HSA-dnCXCL8 外,所有干粉的跨度都小于 2.8。在测量这两个 PSD 时,一些较大的团块将分布分别向 517μm 和 129μm 的 x90 方向移动(图1b、图1c),导致 PSD 变宽。
2、 圆二色光谱测定结构
利用圆二色谱(CD)对 SD 和 FD 后的蛋白质二级结构的变化进行评价,并将其与未处理蛋白质的光谱进行比较。CD 光谱在设备上记录,波长为 190-250nm,使用 1mm 石英比色皿,响应时间 4s。5 次扫描取平均值,并用 PBS 校正背景,计算平均残基椭圆率,并绘制不同曲线。
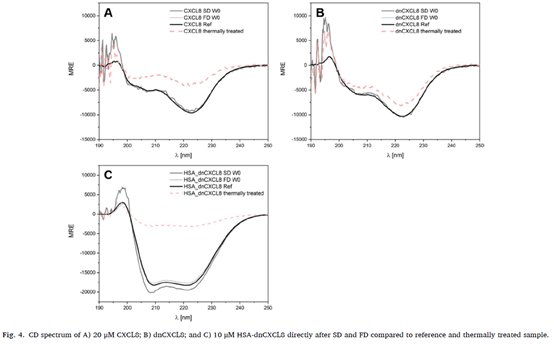
由 图4 显示,经过 SD 和 FD 后的 CD 光谱显示只有轻微的结构变化。液体白细胞介素制剂在 90℃ 温度下热处理5分钟,SD 温度在 60℃ 温度下热处理 5 分钟,会产生轻微的沉淀,但结构保持完整 (图4A)。dnCXCL8 也出现类似的结果。SD 和 FD 均未引起二级结构的改变。即使加热蛋白质也未引起二级结构的变化(图4B)。虽然 HSA-dnCXCL8 具有更明确的α-螺旋结构,但 SD 和 FD 后没有变化。在 90℃ 热处理 5min 后二级结构发生了完全损失 (图4C)。
3、 离液展开测定稳定性
采用荧光光谱检测gdmhcl在0-6M范围内诱导展开,并在SD和FD后和储存3个月后测定蛋白质稳定性。将样品稀释至0.7μM,并在室温下平衡5min。CXCL8 和dnCXCL8 的激发波长为 280nm, HSA-dnCXCL8 的激发波长为 290nm。在 300-400nm 范围内测量所有3种蛋白的发射光谱,并将狭缝宽度设置为 5nm。蛋白质展开的特征是波长移位,并使用 Origin 2019b 的玻尔兹曼进行计算得到如下图谱。
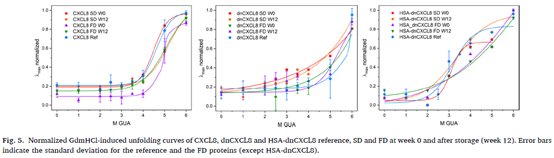
图5 显示,展开的过渡中点和 CXCL8 的相对协同性在很大程度上没有变化。对于 dnCXCL8,无法建立明确的过渡点。对于 FD HSA-dnCXCL8 也观察到了同样的情况。对于参考光谱和 FD 光谱(HSA-dnCXCL8 除外),显示了标准偏差,如图中的误差条所示。
4、 趋化性测试:博伊登室测定
为了检测 SD 和 FD 后以及储存三个月后的白细胞介素的活性,进行了趋化试验测定中性粒细胞的活化和迁移,预计 CXCL8 具有促迁移作用,而 dnCXCL8 和HSA-dnCXCL8 不应表现出任何中性粒细胞迁移激活。使用 NIS-Elements BR 3.2 软件进行细胞计数,计算每种情况下的平均值和标准偏差。
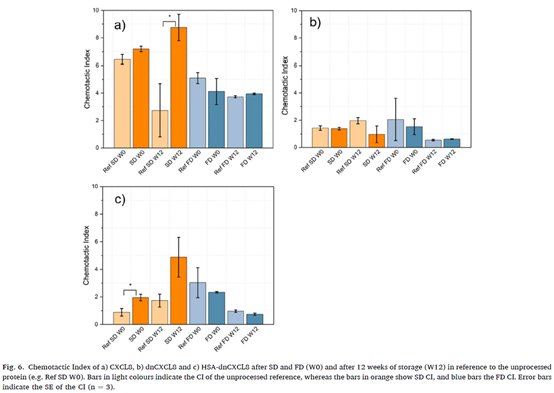
上图显示储存 12 周后 SD CXCL8 的 CI 较对照显著增加 (图6a, p = 0.05)。SD 和 FD CXCL8 在中性粒细胞活化和迁移方面没有变化。对于 dnCXCL8, SD 和 FD 样本的 CI 与各自的参考 CI 相当。HSA-dnCXCL8 在 SD 后 (即W0) 的 CI 显著增加 (图6c, p = 0.04)。
4 结论
本研究针对磷酸盐缓冲盐水配制的白细胞介素(未添加额外添加剂)采用 SD 和 FD 两种干燥方式分别进行深入评估。用纯缓冲液进行的 DoE 确定了一种最佳的 SD 工艺,在 60℃ 的干燥空气温度、100 L/min 的空气流速和 30% 的喷雾速率下具有较高产率,这表明即使是热不稳定的蛋白质也可以喷雾干燥。此外,SD 工艺比 FD 更快、更有效,理论上导致每分钟产量比 FD 高 130 倍(甚至考虑到 SD 的产量仅 63% 和 77% 之间)。FD 粉末呈现饼状结构,而 SD 粉末的粒度为 X50<20μm。这为粒子工程提供了定义粒子特性的可能性,允许更广泛的应用。RM 是可比较的,同样二级结构没有改变,结合亲和力和活性保持至少 12 周,这些结果表明白细胞介素的 SD 是可行的。未来,将继续优化本研究中的工艺参数,并将其转移到具有工业型台式喷雾干燥器中,以更大规模地系统考察粉体产量和工艺时间,从而对 SD 进行全面评估,作为 FD 的替代方案,实现经济快捷高效的生产!
5 文献来源
Comparing freeze drying and spray drying of interleukins using model protein CXCL8 and its variants
最新动态
更多





虚拟号将在 秒后失效
使用微信扫码拨号